反町優理子 早稲田大学生命医科学専攻合田研究室博士1年/国立国際医療研究センター生体恒常性プロジェクト研究生
研究背景
私たちの体を流れる血液には赤血球・白血球・血小板などの血液細胞が含まれています。これらは全て、造血幹細胞(hematopoietic stem cell; HSC)と呼ばれる細胞から分化・産生されます。造血幹細胞は骨髄に存在する組織幹細胞で、健康な若い人の場合、90%近くの細胞が細胞周期を停止して、分化も増殖もせずに休眠状態にあります。一方、出血などで血液細胞が失われると、造血幹細胞は活性化し血液産生を開始します。しかし、歳をとるにつれて造血幹細胞の血液産生能が低下することが知られています。この加齢に伴う造血幹細胞の機能低下は「HSCエイジング」と呼ばれており、白血病や貧血など様々な加齢関連疾患の原因となります。HSCエイジングの分子機構の解明は造血器疾患の病態解明や治療法確立に貢献する重要な研究課題になります。
研究結果
私たちはこれまで造血幹細胞のストレス応答に関わる分子としてp38MAPKファミリーのp38αを同定してきました。そこでp38α欠損マウスを作製し、p38αがHSCエイジングにどのような働きをするのか調べることにしました。
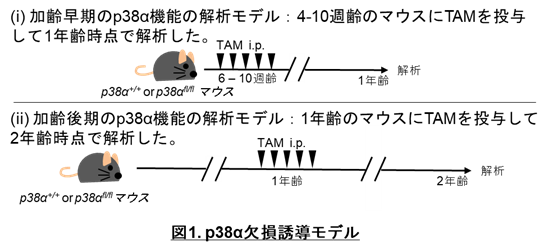
p38αは全身性欠損では胎生致死となるため、本研究ではp38αをtamoxifen(TAM)誘導性に欠損するマウスを作製しました。そして、TAM投与時期を変えて、HSCエイジングが進行する1年齢と2年齢のマウスでそれぞれp38αの機能を検討しました(図1)。その結果、マウスが若齢から1年齢までの加齢早期ではp38αは造血幹細胞機能を維持している一方で、1年齢から2年齢までの加齢後期ではp38αは造血幹細胞の機能をむしろ低下させることが分かりました。さらに病的な老化である早老症病態下でp38αがどのように機能するのかを調べると、p38αは早老症モデルマウスにおいて造血幹細胞の機能維持に重要であることが分かりました。以上の結果より、p38αが生理的加齢プロセスや早老症など、様々な状況ごとに造血幹細胞機能を調節していることを明らかにしました。
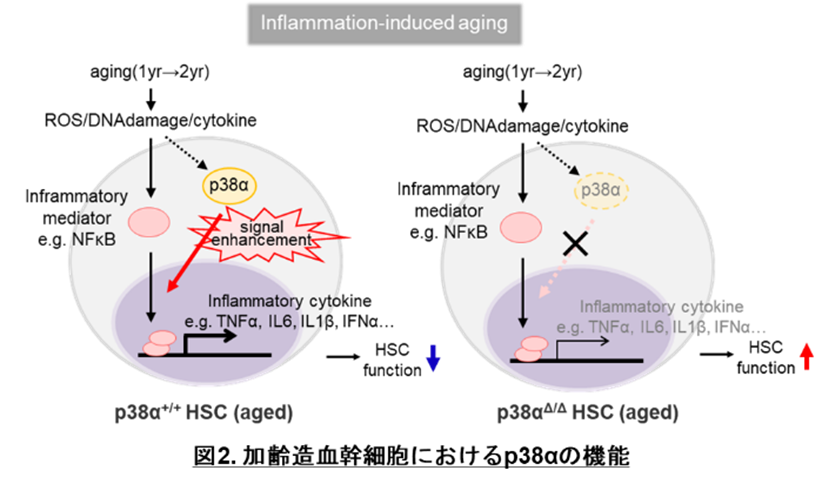
最後に、p38αが造血幹細胞の機能を制御する詳細な分子機序を調べるため、p38αを欠損する造血幹細胞の遺伝子発現解析を行いました。その結果、加齢早期に比べて加齢後期ではp38αが造血幹細胞内部の炎症応答を促進していて、p38α欠損によってこれが緩和されることが分かりました。つまりp38αは加齢後期のステージで炎症応答の促進を介して造血幹細胞の機能を悪化させる可能性が示唆されました(図2)。
本研究は、国立国際医療研究センター、慶應大学、ロンドン大学との共同研究によって得られた成果です。
社会へのインパクト
今回の研究から、HSCエイジングは単調にすすむ連続的な細胞応答の結果ではなく、これまで考えられてきた以上に複雑な制御下で進行することが初めて実験的に証明されました。また、これまで漠然と信じられてきた「p38MAPKはHSCエイジングを誘導する必須シグナルである」という既存のドグマに一つの反例がもたらされました。本研究で得られたHSCエイジング過程で変動する分子機構に関する知見は、HSCエイジングが原因となる造血器悪性腫瘍や早老症の病態解明と治療法の開発に繋がることが期待できます。
今後の展望
HSCエイジングが加齢の各ステージでp38αによりどのように制御されているのか、より詳細な分子メカニズムを調べることで、造血幹細胞機能の回復を促す治療薬の開発に繋がると考えています。特に炎症応答を伴わない正常加齢プロセスの早期や早老症モデルにおいて、p38αが何を標的として造血幹細胞の機能を制御するかを明らかにすることで、加齢のステージや病気の状況に応じた治療法の使い分けにも繋がると考えています。